جان هزاران نفر وابسته به دریافت عضو پیوندی اهدایی است و چاپ اعضای بدن با چاپگر سهبعدی میتواند نجات بخش آنها باشد اما آیا چنین کاری ممکن است؟
به گزارش ایسنا، سالانه تعداد زیادی از افراد در سراسر جهان جان خود را در صف دریافت عضو اهدایی از دست میدهند و حدود هر ۹ تا ۱۰ دقیقه یک بار یک نفر به این صف طولانی اضافه میشود. رسیدگی به این موضوع نیازمند پیش گرفتن رویکردی جدید است. از این رو محققان به فکر ساخت اعضای بدن با استفاده از چاپگرهای سه بعدی و ایجاد اندامها در آزمایشگاه افتادهاند. در ادامه به چگونگی انجام این کار، مزایا، معایب و چالشهای آن میپردازیم.
آیندهای را تصور کنید که بیمار بدون نیاز به منتظر ماندن برای پیدا شدن فردی مناسب برای اهدا، به راحتی با استفاده از سلولهای خود یک اندام را چاپ میکند. این فناوری که “چاپ زیستی” (bioprinting) نام دارد هدف اصلی تحقیقات دکتر کریستف مارکت(christophe marquet)، مدیر مرکز ملی تحقیقات علمی فرانسه در دانشگاه لیون است.
چاپ زیستی به معنای چاپ بافت زنده با استفاده از سلول است و هدف از آن ایجاد بافتهای زنده برای پیوند یا بافتهای خاص برای تحقیقات است. چاپگر زیستی مانند چاپگرهای سهبعدی معمولی کار میکند یعنی از یک طرح دیجیتال برای ساخت یک شی به صورت لایه به لایه استفاده میکند. تنها تفاوت آن در نوع جوهری است که مورد استفاده قرار میدهد. برخلاف پرینترهای سهبعدی رایج، جوهر چاپگرهای زیستی از پلاستیک، پودر یا فلز ساخته نشده و در آن از “جوهر زیستی” استفاده میشود که نوعی ژل حاوی سلولهای زنده است.
برخلاف پرینترهای سهبعدی رایج، جوهر چاپگرهای زیستی از پلاستیک، پودر یا فلز ساخته نشده و در آن از “جوهر زیستی” استفاده میشود که نوعی ژل حاوی سلولهای زنده است.
دکتر “مارکت” میگوید: ما تا به امروز موفق به ساخت چندین غضروف شدهایم و در حال کار بر روی ریه هستیم. برخی از محققان نیز بر سایر اندامها مانند کبد، کلیه و قلب هستند.

چاپ سهبعدی را میتوان به چهار دسته تقسیم کرد
چاپ زیستی مبتنی بر جوهرافشان، چاپ زیستی به کمک فشار، چاپ زیستی با کمک لیزر و استریولیتوگرافی.
چاپ زیستی مبتنی بر جوهرافشان مانند پرینترهای معمولی کار میکند اما جوهر زیستی به جای کاغذ روی یک بستر هیدروژل یا ظرف کشت چاپ میشود.
در چاپزیستی با کمک فشار مواد زیستی که بیشتر ظاهری خمیری دارند از دهانه یک نازل در مقیاس میکروسکوپی یا میکروسوزنی خارج شده و بر روی یک بستر ثابت فرو میریزد و لایهبندی میشود تا ساختار سهبعدی مورد نظر تشکیل شود.
در چاپ زیستی به کمک لیزر، از لیزر به عنوان منبع انرژی برای قرار دادن مواد زیستی روی یک بستر استفاده میشود در حالی که در استریولیتوگرافی از یک مایع پلیمری استفاده میشود که وقتی تحت تابش اشعه ماورابنفش قرار میگیرد تبدیل به ساختاری جامد میشود.
تاریخچه چاپگرهای سهبعدی
ساخت چاپگرهای سهبعدی به دهه ۱۹۸۰ برمیگردد، زمانی که چارلز هال، یک مهندس آمریکایی اولین چاپگر سهبعدی را ساخت که میتوانست اجسام جامد را با طراحی به کمک رایانه(CAD) ساخت.
این چاپگر لایههای متوالی از یک فتوپلیمر مبتنی بر اکلریک را روی یک سطح قرار میداد و سپس این لایهها توسط نور فرابنفش به یکدیگر متصل میشدند و شی جامدی ساخته میشد.
این فناوری ساده، صنعت تولید مواد را متحول کرد. به تدریج در اواخر دهه ۱۹۹۰ چاپ سهبعدی پا به عرصه مراقبتهای درمانی گذاشت و جراحان شروع به چاپ سهبعدی ایمپلنتهای دندان، پروتزهای سفارشی و مثانه کردند. اصطلاح چاپ زیستی زمانی ایجاد شد که به مادهی در حال چاپ، نام “جوهر زیستی” دادند. این ماده حاوی مواد زیستی، سلولهای زنده یا مولکولهای زیستی فعال بود.
باید خاطرنشان کرد که کاربرد چاپگرهای سهبعدی تنها به چاپ اندامهای بدن محدود نمیشود و از آن در ساخت دارو، مطالعه مکانیسمهای بیماری یا ایجاد داروهای شخصیسازی شده نیز میتوان استفاده کرد.
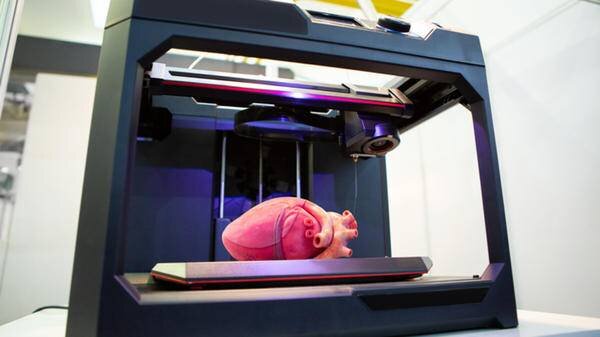
چاپ زیستی چگونه عمل میکند؟
به گفتهی دکتر “مارکت”، در فرآیند چاپسهبعدی یک چاپگر و جوهر دخیل است که در مورد چاپگرهای زیستی یک جوهر زیستی وجود دارد. ایده آن است که چندین سلول از بیمار گرفته شود و این سلولها درون جوهر زیستی قرار میگیرند. بنابراین جوهر زیستی باید بتواند به خوبی میزبان سلولها باشد و آنها را زنده نگه دارد.
به گفتهی دکتر “مارکت”، در فرآیند چاپسهبعدی یک چاپگر و جوهر دخیل است که در مورد چاپگرهای زیستی یک جوهر زیستی وجود دارد.
سلولها به اکسیژن، قند و مواد دیگر نیاز دارند. این جوهر زیستی ظاهری شبیه به ژلهای مو دارد و از حجم زیادی از آب و مقادیر کمی از آن چه ما “مادهزیستی” مینامیم ساخته شده است. این ماده از پروتئین و موادی مشابه آن ساخته میشود.
این مواد بوسیله چاپگر سهبعدی روی سطح مورد نظر قرار میگیرند تا اندام یا بافت را بسازند. اندامها و بافتهای مختلفی را با این روش میتوان ایجاد کرد که در ادامه به چند مورد از آنها اشاره میکنیم.
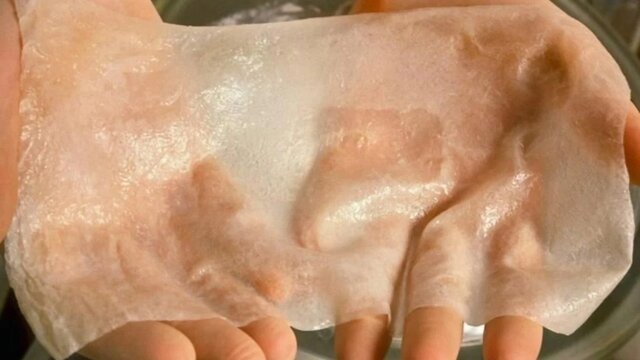
پوست
راهی برای درمان بیماران سوانح سوختگی
دکتر “مارکت” و همکارانش در حال حاضر بر روی پروژهای به نام “BLOC-PRINT” کار میکنند و ارتش فرانسه نیز با آنها همکاری میکند. هدف آنها بازسازی پوست قربانیان سوختگی با استفاده از چاپ زیستی به طور مستقیم و در لحظه در اتاق عمل است.
گزینههای درمانی در این مورد بسیار محدود است. اگر سوختگی بیمار بیش از ۷۰ درصد باشد، پوست سالم کافی برای پیوند زدن وجود نخواهد داشت. اگرچه پوستهای آزمایشگاهی مصنوعی وجود دارند اما آنها تنها لایه خارجی پوست را بازسازی میکنند و در برخی عناصر کاربردی اساسی دچار کمبود هستند و احتمال باقی ماندن جای زخم را افزایش میدهند.
روشی که گروه “مارکت” در حال توسعه آن هستند نیازمند نمونهبرداری از سلولهای پوست بیمار و افزودن آن به جوهر زیستی است.
“مارکت” در این مورد توضیح میدهد: هدف ما چاپ زیستی پوست به صورت مستقیم روی بیمار است و ما میخواهیم این کار را مستقیما در اتاق عمل انجام دهیم.
“مارکت” میگوید: هدف ما چاپ زیستی پوست به صورت مستقیم روی بیمار است و ما میخواهیم این کار را مستقیما در اتاق عمل انجام دهیم.
ما نمونههایی از سلول پوست فرد برمیداریم و آن را به جوهر زیستی وارد میکنیم و سپس یک دست رباتیک در این جا به ما کمک خواهد کرد. این دست رباتیک بالا و پایین میرود و ژل را روی پوست فرد قرار میدهد. خود فرد به عنوان ماشین پخت برای پوست عمل میکند به این صورت که آنها به رشد سلولها کمک میکنند. بنابراین شما پوست را چاپ میکنید و منتظر میمانید تا بازسازی شود. این کار پیوند زدن نیست. پس از دو هفته یک پوست کاملا بازسازی شده خواهید داشت.
در چنین روشی نیازی به برداشتن بخش زیادی از پوست سالم برای پیوند به بخشهای آسیب دیده نیست و تکهای از پوست که تنها ۱۰ درصد اندازهی سوختگی است میتواند برای رشد سلولهای کافی برای چاپ سهبعدی مورد استفاده قرار بگیرد. از یک اسکنر نیز میتوان برای تعیین اندازه و عمق زخم استفاده کرد. با پیشرفت در این حوزه، محققان میخواهند بدانند که آیا میتوان از سلولهای بنیادی مایع آمنیوتیک و جفت برای ترمیم زخمها استفاده کرد یا خیر.
“مارکت” باور دارد که این فناوری طی ۱۰ سال آینده به طور کامل توسعه مییابد و در بیمارستانها مورد استفاده قرار خواهد گرفت.
محققان دانشکده پزشکی “ویک فارست”(Wake Forest) نیز موفق به ساخت نمونه اولیه چاپگری شدهاند که میتواند سلولهای پوست را مستقیما بر روی محل سوختگی چاپ کند. علاوه بر آن محققان موسسه “پلی تکنیک رنسلیر”، نیویورک نیز با استفاده از ترکیب دو جوهر زیستی، پیوندهای پوستی دارای عروق را پرورش دادند. این پوستها تاکنون تنها به موشهای دارای نقص ایمنی پیوند زده شدهاند اما میتوان از آنها برای جایگزین کردن پیوندهای پوستی استفاده کرد.
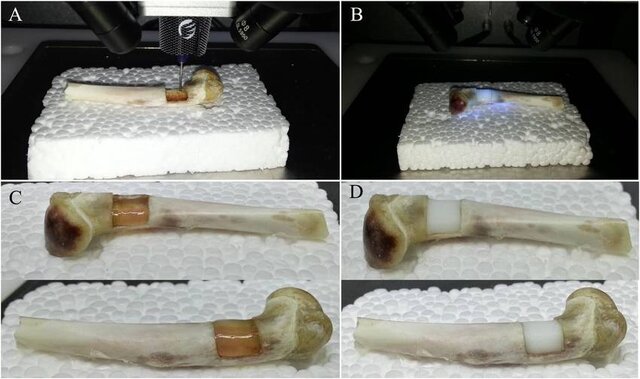
چاپ استخوان
محققان دانشگاه سوانسی(Swansea) در بریتانیا با استفاده از مواد زیستی با دوام و احیاکننده یک فرآیند چاپ زیستی برای ساخت ماده بین سلولی بافت استخوان مصنوعی(ماتریس استخوان) ایجاد کردند.
در حال حاضر برای شکستگیهای شدید استخوان، پیوند استخوان و جایگزین کردن استخوانهای از دست رفته یا آسیبدیده از مواد مصنوعی مبتنی بر سیمان استفاده میشود که اغلب یکپارچگی مکانیکی مناسبی ندارند و مانع از تشکیل بافت میشوند. این در حالی است که استخوانهای ساخته شده با چاپگر زیستی میتواند به حل این معایب کمک کند.
محققان دانشگاه نیو ساوت ولز(New South Wales) در سیدنی استرالیا دست به ساخت فرآیند جدیدی زدهاند که میتوان از آن درون بدن انسان استفاده کرد. این فرآیند درد را کاهش میدهد و زمان بهبودی را تسریع میکند.
محققان دانشگاه نیو ساوت ولز(New South Wales) در سیدنی استرالیا دست به ساخت فرآیند جدیدی زدهاند که میتوان از آن درون بدن انسان استفاده کرد. این فرآیند درد را کاهش میدهد و زمان بهبودی را تسریع میکند.
درمان سرطان استخوان ممکن است به برداشتن بخشهایی از استخوان منجر شود و قربانیان تصادفات نیز ممکن است به ترمیم گسترده استخوان نیازمند باشند. با این روش جدید میتوان بافت استخوان را دقیقا در طول عمل جراحی ایجاد و استفاده کرد.
با ترکیب یک ماده سرامیکی که ساختار استخوان را شبیهسازی میکند و سلولهای خود بیمار، میتوان یک جوهر زیستی ایجاد کرد و دانشمندان به راهی دست یافتهاند که میتوان این ماده استخوانی جدید را در داخل بدن ایجاد کرد.
به گفتهی “کریستوفر کیلیان”(Kristopher Kilian)، اگر در طول جراحی بخشی از استخوان بیمار برداشته شود میتوان آن استخوان را اسکن کرد و به طور مستقیم حفره ایجاد شده را با چاپگر سهبعدی پر کرد.
برخلاف روشهای قبلی که در آن چاپگرها قادر به کار در دمای اتاق نبودند و برای ضدعفونی کردن مواد استخوانی جدید نیاز به مواد شیمیایی بود، این چاپگر سبک و قابل حمل است و میتوان آن را به اتاق عمل برد.
علاوه بر درمان بیماران، از استخوانهای مصنوعی میتوان برای مدلسازی بیماریهای استخوان و نظارت بر داروها نیز استفاده کرد.

قلب
گروهی از دانشمندان دانشگاه تلآویو با استفاده از سلولهای چربی از یک اهدا کننده موفق به چاپ یک قلب کامل با عروق شدند. سلولهای چربی کشت شده و برای تبدیل شدن به سلولهای قلب مجددا برنامهریزی شدند. کل ساختار قلب با تمام سلولها، رگهای خونی و بطنها ساخته شد. این ساختار براساس تصاویر گرفته شده از قلب اهداکننده ایجاد شد.
این فناوری هنوز در مراحل اولیه خود قرار دارد. قلبی که محققان ایجاد کردهاند به اندازه قلب یک خرگوش است و قادر به پمپ کردن خون نیست. آنها امیدوارند زمانی که این قلبها قادر به تپش و پمپ خون شدند بتوان آن را بر روی حیوانات آزمایش کرد.
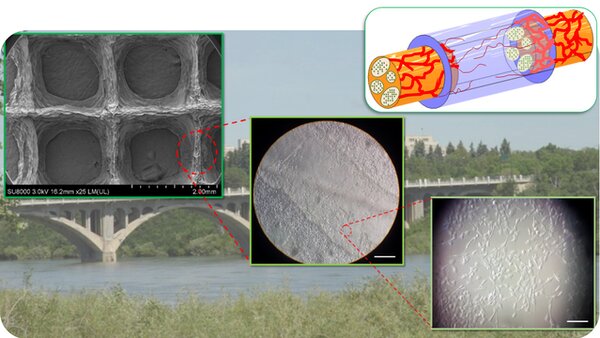
ترمیم اعصاب
تقریبا سالانه حدود ۲۲.۶ میلیون بیمار در سراسر جهان به جراحی مغز و اعصاب نیاز پیدا میکنند. این آسیبها در درجه اول ناشی از حوادثی مانند تصادفات رانندگی، صدمه دیدن در محل کار و زایمان است.
روشهای کنونی جراحی به جراحان این امکان را میدهد تا پایانههای عصبی را بار دیگر سازماندهی کنند و رشد اعصاب را بهبود بخشند، با این حال بهبود سیستم عصبی آسیبدیده تضمین نمیشود و عملکردهای طبیعی فرد تقریبا هیچوقت به طور کامل باز نمیگردد.
مطالعه بر روی موشها نشان داده که اگر آسیب بیش از دو سانتیمتر از اعصاب را از بین ببرد، این شکاف نمیتواند به درستی پر شود و این موضوع ممکن است منجر به از دست دادن عملکرد یا حس عضلات شود. در این شرایط استفاده از یک داربست برای برقرار کردن ارتباط بین دو عصب آسیبدیده اهمیت زیادی دارد.
چاپگر سهبعدی میتواند به ساخت ساختارهای متخلخل که از سلولهای عصبی بیمار و یک ماده زیستی ساخته شده است کمک کند تا بین اعصاب آسیبدیده ارتباط برقرار شود. محققان از مادهای مشتق شده از جلبک در این مطالعه استفاده کردند زیرا بدن انسان این ماده را پس نمیزند. اگرچه این روش هنوز روی انسانها آزمایش نشده است اما این پتانسیل را دارد که به بیماران کمک کند.
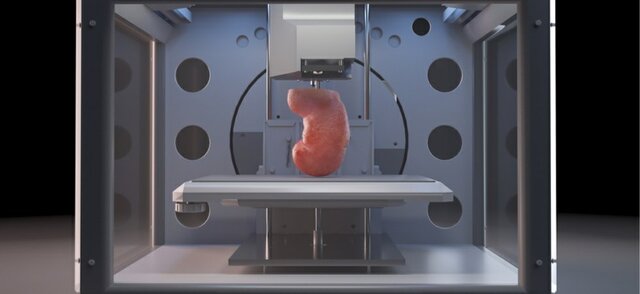
کلیه و مثانه
حدود دو ماه طول میکشد که یک کلیه چاپ شده، رشد کند. این درحالی است که این زمان برای مثانه کوتاهتر است. مثانه که یکی از اعضای بسیار ساده بدن است تنها دو نوع سلول دارد. در مقابل کلیه ۲۰ نوع سلول دارد که همهی آنها باید بازتولید شوند و بتوانند عملکرد کلیه را انجام دهند.
برای چاپ کلیه باید یک داربست زیست تخریبپذیر ساخت و سلولها را روی آن چاپ کرد. سپس این سلولها درون یک میکروژل رشد میکنند. باید اطمینان حاصل کرد که این سلولها مواد مغذی مورد نیاز برای ساخت سلولهای بافت سالم را دریافت میکنند و در نهایت بافت بالغ درون بدن بیمار قرار داده میشود. درون بدن بیمار و مدت کوتاهی پس از جراحی داربستها از بین میروند و به طور طبیعی دفع میشوند. شرکتهای بیوتکنولوژی تلاش میکنند که از سلولهای بنیادی خود فرد به عنوان جوهر استفاده کنند. این کار خطر پس زده شدن بافت را کاهش میدهد.
شرکت بیوتکنولوژی “CollPlant” بر روی کلیههای قابل چاپ کار میکند و در تلاش است تا نیاز به پیوند کلیه در آینده را کاهش دهد. کلیههای چاپ سهبعدی شده کوچک نیز تولید شدهاند که برای آزمایش داروها مورد استفاده قرار خواهند گرفت.
شرکت بیوتکنولوژی “CollPlant” بر روی کلیههای قابل چاپ کار میکند و در تلاش است تا نیاز به پیوند کلیه در آینده را کاهش دهد.
به نظر میرسد دستکم ۵۰ سال دیگر طول بکشد تا این کلیهها به صورت گسترده در دسترس قرار بگیرند. توسعه چاپ سهبعدی در حوزه پزشکی هنوز در مراحل اولیه قرار دارد اما این موضوع از هیجان آن کم نمیکند.
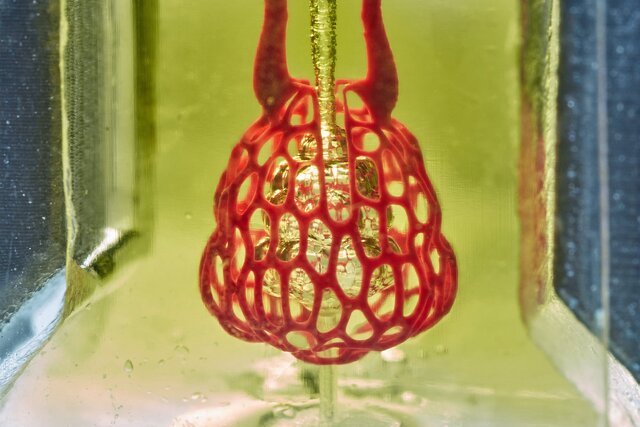
ریه
محققان دانشگاه علم و فناوری پوهانگ(POSTECH) در کره جنوبی موفق به ایجاد یک مدل سهبعدی از ریه شدهاند که دارای انواعی از سلولهای آلوئولی بوده و با استفاده از چاپ زیستی جوهرافشان ساخته شده است.
آلوئولها یا کیسهی هوایی(alveolus) ساختارهای کیسه مانندی به قطر حدود ۲۰۰ میکرومتر هستند که از نایژکهای تنفسی، مجاری آلوئولی و کیسههای آلوئولی بیرون میآیند و سلولهای آلوئولی سطح آلوئولها را میپوشانند.
اکسیژن وارد شده به بدن از طریق راههای هوایی به آلوئولها میرسد و با دیاکسید کربن که توسط خون حمل میشود جایگزین میشود. آلوئولها از یک لایه نازک از سلولهای پوششی ساخته شده و توسط مویرگهای نازکی احاطه شدهاند. غشاهای آلوئولی یک ساختار سه لایه از لایه پوششی(epithelial)، غشای پایه(Basement membrane) و لایه درونرگی(endothelial) ساخته شدهاند. تاکنون چالشهایی برای شبیهسازی دقیق آلوئول با چنین ساختارهای نازک و پیچیدهای وجود داشته است.
محققان برای انجام این کار از یک مدل سد سه لایه آلوئولی با ضخامت ۱۰ میکرومتر استفاده کردند و آن را با استفاده از چاپگر سهبعدی چاپ کردند.
به گفتهی محققان این مدل جدید سد آلوئولی پاسخ فیزیولوژیکی مشابه بافت واقعی در برابر ویروس ایجاد میکند.

آینده با اندامهای چاپ شده چگونه خواهد بود؟
دکتر “مارکت” میگوید که در نهایت روزی این اندامها وارد بیمارستانها میشوند. اما گام مهم بعدی نحوهی رشد آنها به صورت کامل در آزمایشگاه است و اینکه بتوان آنها را حفظ کرد و همچنین بتوان آنها را در بدن بیمار قرار داد. در چنین مطالعاتی هدف ساخت بافتها با اندازه واقعی است و برای رسیدن به این هدف باید بر چالشهایی نیز غلبه کرد. اولین و مهمترین آن ایجاد عروق درون بافت و اندام است. سلولها به گردش خون نیاز دارند و انجام چنین کاری دشوار است. زیرا چنین ساختارهایی پیچیده هستند. شما نیاز به لولههای کوچکی دارید که تبدیل به لولههای بزرگتر شوند و این لولههای بزرگ نیز بزرگتر شوند. پیش از این ما هرگز چیزی که بتواند اتصالات عروقی برقرار کند را به بدن پیوند نزدهایم. چاپ یک هیدروژل بزرگ کار آسانی است اما تبدیل کردن این جوهر زیستی به بافت و ارگانهای کارآمد موضوع دیگری است. زمانی که شما در بدن مادرتان رشد میکنید همه چیز با همدیگر کار میکند بنابراین دادههای زیادی از اندامهای مختلف وجود دارد. این اندامها با هم “حرف” میزنند. اما اگر یک اندام را خارج از بدن و در آزمایشگاه رشد دهید، عضوی تنها خواهد بود بدون هیچ ارتباطی و هیچ دادهای از خارج. کار سختی است که بگوییم من سلولهای کبد را دارم و ظاهر آن را دارم و یک کبد میسازم. این کار دشوار است. ایده آن است که این بافت و اندامها را درون دستگاههای مخصوصی قرار دهیم که شبیه به درون بدن است.
در این صورت دما کنترل شده است و شما میتوانید به آن اطلاعات بدهید و در این صورت میتوان هر آنچه میخواهید بسازید. من فکر میکنم طی ۲۰ سال آینده به این هدف دست یابیم. از نظر تکنیکی هیچ شکی ندارم که این اتفاق خواهد افتاد اگرچه از لحاظ اخلاقی مطمئن نیستم. ما هنوز نمیدانیم که اگر به چنین قدرتی دست پیدا کنیم هزینه آن و واکنش جامعه چقدر خواهد بود.
من فکر میکنم طی ۲۰ سال آینده به این هدف دست یابیم. از نظر تکنیکی هیچ شکی ندارم که این اتفاق خواهد افتاد اگرچه از لحاظ اخلاقی مطمئن نیستم. ما هنوز نمیدانیم که اگر به چنین قدرتی دست پیدا کنیم هزینه آن و واکنش جامعه چقدر خواهد بود.
چالشهای دیگری نیز در این راستا وجود دارد. در حال حاضر تعداد محدودی از جوهرهای زیستی وجود دارد که علاوه بر قابل چاپ بودن بتوانند ساختار مورد نظر برای بازسازی عملکرد اندام پس از چاپ را ایجاد کنند. در حالی که جوهرهای زیستی ساخته شده از هیدروژل طبیعی برای رشد سلولی مفید هستند، هیدروژلهای مصنوعی از نظر مکانیکی قویترند. بنابراین جوهرهای زیستی ترکیبی باید با در نظر گرفتن همهی این جوانب طراحی شوند.
علاوه بر آن فرآیند چاپ زیستی نیز باید برای سلولها مناسبسازی شود. تنشهای اعمال شده در طول فرآیند چاپ برای رشد سلول مضر است و میتواند باعث بیان تغییر ژن شود.
به طور کلی حوزهی تحقیقاتی چاپ سهبعدی به سرعت در حال تکامل است و با چالشهای زیادی روبهرو است اما میتواند روزی جهان پزشکی و مراقبتهای درمانی را متحول کند و سالانه نجاتبخش جان هزاران نفر شود.
منبع: خبرگزاری دانشجویان ایران





