فناوری "کریسپر" یا "قیچی ژنتیکی" یک روش درمانی پیشرفته برای ویرایش ژن است که در آینده نزدیک میتواند تحول بزرگی را در حوزه درمان بیماریهای لاعلاج ایجاد کند.
“کریسپر”(CRISPR)، فناوری پیشرفتهای است که میتوان از آن برای ویرایش ژن استفاده کرد و شاید همین ویژگی آن بتواند جهان را متحول کند.
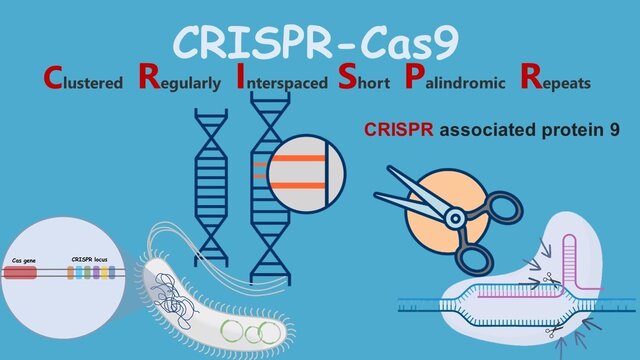
“کریسپر”(CRISPR) مخفف عبارت انگلیسی Clustered Regularly Interspaced Short Palindromic Repeats به معنی “تناوبهایِ کوتاهِ پالیندرومِ فاصلهدارِ منظمِ خوشهای” بخشی از دیانای پروکاریوت هستند که حاوی تناوبهای کوتاهِ توالیهای بنیادین هستند. بخشی از سیستم کریسپر “پروتئین Cas9” است. این پروتئین قابلیت جستجو، برش زدن و تغییر دی ان ای(DNA) را دارد. قبل از این تکنیک از روش “تحویل یا انتقال ژن” استفاده میشد، به این صورت که از یک ناقل ویروسی یا غیرویروسی برای انتقال ژن سالم به ژنوم سلول میزبان استفاده میشد، ولی در روش کریسپر، ژن معیوب برش داده میشود و ژن سالم به جای آن قرار میگیرد. استفاده از آنزیم Cas9 خطر کمتری نسبت به روش قبلی که یک ژن خارجی وارد ژنوم میشد دارد، زیرا گاهی ژن خارجی به سرطان منجر میشود اما ژنی که از طریق کریسپر ترمیم شود کنترل شده است. نام دیگر این تکنیک “قیچی ژنتیکی” است که به دلیل ساز و کار آنزیم “کَس9” (Cas9) هست. این آنزیم به عنوان یک جفت قیچی مولکولی میتواند دو رشته DNA را در محل خاصی از ژنوم برش دهد.
ماهیت کریسپر”، ساده است. این فناوری، راهی است که به یافتن بخش مشخصی از DNA درون سلول کمک میکند. مرحله بعدی در روش ویرایش ژن کریسپر معمولاً تغییر دادن همان بخش DNA است. در هر حال، کریسپر برای انجام کارهای دیگری مانند فعال یا غیرفعال کردن ژنها بدون تغییر دادن ترتیب آنها نیز مناسب است.
پیش از رونمایی از روش کریسپر، روشهایی برای ویرایش ژنوم برخی از گیاهان و جانوران وجود داشت اما این روشها سالها زمان میبردند و صدها هزار دلار هزینه داشتند. کریسپر کمک کرد تا این کار، کمهزینه و ساده شود.
کریسپر در حال حاضر به صورت گسترده در پژوهشهای علمی به کار میرود و احتمالا به زودی بسیاری از گیاهان و حیوانات به واسطه آن دچار تغییر میشوند. در واقع، در حال حاضر هم برخی از مردم، غذاهایی را مصرف میکنند که با فناوری کریسپر تغییر یافتهاند.
فناوری کریسپر، قابلیت تغییر دادن دارو را نیز دارد و به پژوهشگران کمک میکند تا نه تنها بسیاری از بیماریها را درمان کنند، بلکه بتوانند به پیشگیری از آنها بپردازند. حتی شاید بتوانیم این فناوری را برای تغییر ژنوم فرزندان خود به کار بگیریم. تلاش برای انجام دادن این کار در چین، به عنوان یک کار غیراخلاقی شناخته شده است اما برخی باور دارند که این کار در آینده میتواند به نفع کودکان باشد.
کریسپر برای اهداف دیگری نیز استفاده میشود؛ از “انگشتنگاری سلولها”(ثبت وقایع درون سلولها) گرفته تا هدایت تکامل و ترغیب ژنها.
کلید کریسپر، پروتئین “کَس۹”(Cas۹) است که به صورت گسترده مورد استفاده دانشمندان قرار میگیرد. این پروتئین را میتوان به سادگی برنامهریزی کرد تا توالی مورد نظر را پیدا کند و به آن متصل شود.
هنگامی که پروتئین کَس۹ به همراه بخشی از آرانای راهنما به سلول اضافه میشود، به آرانای راهنما متصل میشود و سپس در امتداد رشتههای DNA حرکت میکند تا به دنبالهای طولانی از DNA برسد که با بخشی از توالی آرانای مطابقت دارد و سپس به آن متصل شود.
پروتئین استاندارد کَس۹ ، در محل مورد نظر از DNA برش ایجاد میکند. هنگامی که برش ترمیم میشود، جهشهایی پدید میآیند که معمولا یک ژن را غیرفعال میکنند. این رایجترین کاربرد کریسپر است که به آن ویرایش ژنوم یا ویرایش ژن گفته میشود.
کریسپر را میتوان برای ایجاد تغییرات دقیق مانند جایگزینی ژنهای معیوب مورد استفاده قرار داد اما این کار بسیار دشوارتر است.
کریسپر، یک فناوری ویرایش ژن است که آمادگی دارد تا انقلابی را در پزشکی ایجاد کند. پژوهشگران سعی دارند درمانهای مبتنی بر کریسپر را برای طیف وسیعی از بیماریها از جمله بیماریهای موروثی چشم، بیماریهای عصبی مانند آلزایمر و هانتینگتون و بیماریهایی مانند سرطان و ایدز ارائه دهند. در حقیقت، آزمایشهای کریسپر روی بسیاری از این بیماریها در حال انجام شدن است.
چگونه می توان از کریسپر برای درمان بیماریها استفاده کرد؟
پژوهشگران با استفاده از فناوری کریسپر میتوانند هر بخشی از DNA مورد نظر را به طور دقیق ویرایش کنند. این کار پیشتر با استفاده از سایر ابزارهای ویرایش ژن، قابل دستیابی نبود. امکان ویرایش جهش بیماری برای تصحیح خطاهای ژنتیکی، فرصتهایی را برای درمان آن دسته از بیماریها ارائه میدهد که مدتهاست از نتایج پژوهشهای پزشکی فرار کردهاند.
کریسپر میتواند تعدادی از بیماریهای ژنتیکی را درمان کند؛ از بیماریهای خونی مانند کمخونی داسی شکل گرفته تا سرطان. فهرست بیماریهایی که پژوهشگران در حال حاضر سعی دارند با کمک فناوری کریسپر با آنها مبارزه کنند، روز به روز در حال افزایش است. دادههای حاصل از آزمایشهای بالینی منتشر شده نشان داده است که کریسپر در درمان بیماران مبتلا به کمخونی داسی شکل و همچنین تالاسمی بتا موفق بوده است.
با توجه به توسعه این فناوری ویرایش که امکان درج، حذف و تغییر دادن بخشهای مورد نظر ژنوم را فراهم میکند، دانشمندان تمایل دارند که یک ابزار جدید را به حوزه ویرایش ژنوم اضافه کنند و برای ارائه گزینههای درمانی بیشتر امیدوار هستند.
کاربرد کریسپر در درمان سرطان
با موفقیتهای اخیر کریسپر در آزمایشهای بالینی مربوط به درمان چندین بیماری، مردم بیش از هر زمان دیگری در مورد این فناوری، هیجانزده شدهاند و درباره این پرسش فکر میکنند که آیا کریسپر میتواند سرطان را درمان کند؟ پژوهشهای بسیاری برای پاسخ دادن به این پرسش، در حال انجام شدن است.
در اینجا به برخی از پژوهشهایی میپردازیم که دانشمندان حوزه سرطان آنها را انجام دادهاند و امیدوارند که بتوانند با کمک فناوری کریسپر، این بیماری را در انسان درمان کنند.
لوسمی حاد لنفاوی سلول B
لوسمی حاد لنفاوی سلول B، نوعی سرطان است که مغز استخوان طی آن، سلولهای ایمنی نارس موسوم به “لنفوسیتها”(Lymphocytes) را بیش از اندازه تولید میکند. این نوع سرطان معمولا در دوره کودکی و همراه با تب و کبودی ظاهر میشود.
این نوع سرطان، بسیار سریع گسترش مییابد و حتی اگر زود تشخیص داده شود، اغلب نسبت به شیمیدرمانی واکنش نشان نمیدهد. برای درمان این بیماری معمولا به پیوند سلول بنیادی نیاز است که بسیاری از بیماران به آن دسترسی ندارند.
یکی از پژوهشهای مربوط به این زمینه، توسط “واسیم قاسم”(Waseem Qasim)، پژوهشگر “کالج دانشگاهی لندن”(University College London) انجام شد. قاسم در این پژوهش، آزمایشهایی را با استفاده از روشهای ویرایش ژن کریسپر و با هدف بهبود درمان با “سلولهای تی کایمریک گیرنده آنتیژن(CAR T cells) انجام داد. تمرکز او بر استفاده از این روشها برای درمان کودکان بیمار مبتلا به لوسمی حاد لنفاوی سلول B است.
بررسی دیگری که توسط پژوهشگران چینی و به سرپرستی “هان ویدانگ”(Han Weidong)، “پژوهشگر بیمارستان نظامی ۳۰۱”(۳۰۱ Military Hospital) انجام شده است، فناوری کریسپر را برای مهندسی کردن سلولهای ایمنی بیماران به کار میگیرد تا بتوانند سلولهای سرطانی را که پروتئین “CD19” را بیان میکنند، هدف قرار دهند و از بین ببرند. پژوهشگران در آزمایش بالینی این پروژه سعی دارند درمان با سلولهای تی کایمریک گیرنده آنتیژن را در بیماران مبتلا به لوسمی حاد لنفاوی سلول B به کار بگیرند. آنها نشان دادهاند که این بیماری با بیان پروتئین CD19 مرتبط است.
نتایج این آزمایشهای بالینی، تاثیر درمان با سلولهای تی کایمریک گیرنده آنتیژن را نشان خواهند داد. پیامدهای درمان سرطان با کمک فناوری کریسپر باید پیش از به کارگیری گسترده آن در حوزه درمان، بررسی و تایید شود.
سرطانهای ریه و مری
درمان سرطان مری مانند انواع خاصی از سرطان ریه، چالش برانگیز است. به ویژه، بسیاری از سرطانهای ریه در برابر شیمیدرمانی، مقاوم هستند و سرطان مری اغلب در اواخر مرحله پیشروی خود تشخیص داده میشود و ضعف پیامدهای درمان را در پی دارد.
در بسیاری از سرطانها از جمله سرطان ریه و مری، رشد تومور مستقیما با پروتئین “PD-1” همراه است. این پروتئین که روی سطح سلولها قرار دارد، واکنش ایمنی طبیعی بدن را تنظیم میکند. در یک روش مبتنی بر کریسپر که توسط “جوانهویی کای”(Juanhui Cai)، پژوهشگر “دانشگاه علوم پزشکی هبی”(Hebei Medical University) چین ابداع شده است، PD-1 به منظور افزایش فعالیت ضد توموری سلول تی، در سلولهای بیماران مبتلا به سرطان حذف میشود.
یک کارآزمایی بالینی که به تازگی به پایان رسیده، ژن درمانی مبتنی بر کریسپر را در بیماران مبتلا به “سرطان ریه سلول غیر کوچک”(NSCLC) بررسی کرده است. این بررسی نشان داد که کاربرد بالینی سلولهای تی ویرایش شده با فناوری کریسپر، ایمن و امکانپذیر است.
همچنین این روش درمانی مبتنی بر کریسپر، یک روش ایدهآل برای درمان موثر سرطان مری است. نتایج برخی از این آزمایشهای بالینی نشان داده است که درمان مبتنی بر کریسپر میتواند برای درمان سرطان ریه و مری، بدون خطر و امکانپذیر باشد. پیش از این که درمان به طور گسترده در دسترس قرار بگیرد، باید اثرات بلندمدت و اثرات خارج از هدف آن ارزیابی شوند.
مولتیپل میلوما
“مولتیپل میلوما”(Multiple Myeloma)، نوعی از سرطان است که در مغز استخوان ایجاد میشود و با بروز ناهنجاریهایی در سلولهای پلاسما همراه است. این ناهنجاریها باعث میشوند که سلولهای پلاسما، به صورت خارج از کنترل تکثیر شوند و تومورهایی را در استخوان ایجاد کنند.
درمان مولتیپل میلوما با کمک فناوری کریسپر، ایمنی و اثربخشی یک روش مبتنی بر کریسپر موسوم به “CTX120” را در افراد مبتلا به انواع عود کننده یا مقاوم مولتیپل میلوما را مورد بررسی قرار میدهد. پیشبینی میشود که بررسی افزایش دوز و ارزیابی منسجم این روش، در اوایل سال ۲۰۲۷ به پایان برسد.
پژوهشی که در شرکت زیستفناوری”Allogene” در حال انجام شدن است، اثربخشی یک روش درمانی موسوم به “ALLO-605” را مورد بررسی قرار میدهد که در حال حاضر در مراحل پیشبالینی به سر میبرد.
نتایج کارآزمایی بالینی CTX120، اثربخشی و کارآیی درمانهای مبتنی بر کریسپر را تعیین خواهد کرد. اثرات بلندمدت و خارج از هدف این درمان باید پیش از تجویز گسترده درمان مورد بررسی و رسیدگی قرار بگیرند. روش ALLO-۶۰۵ به احتمال زیاد چند سال زمان خواهد برد تا به آزمایشهای بالینی در مقیاس بزرگتر برسد که روی انسان انجام میشوند.
سرطان دهانه رحم
“ویروس پاپیلوم انسانی”(HPV)، عامل ۷۰ درصد از سرطانهای دهانه رحم است. در حال حاضر واکسنی وجود دارد که از انسانها در برابر ابتلا به ویروس پاپیلوم انسانی محافظت میکند اما هنوز روشی برای درمان بیماران مبتلا به آن در دسترس نیست.
پژوهشگران در حال حاضر سعی دارند فناوری کریسپر را به عنوان روشی برای از بین بردن ویروس پاپیلوم انسانی مورد استفاده قرار دهند. پژوهشی که به سرپرستی “هو ژنگ”(Hu Zheng)، پژوهشگر “دانشگاه سون یات سن”(SYSU) انجام شده است، فناوری کریسپر را برای هدف قرار دادن ژنهای ویروس پاپیلوم انسانی و از بین بردن ویروس مورد استفاده قرار میدهند.
یک گروه پژوهشی دیگر به سرپرستی “نیگل مک میلان”(Nigel McMillan)، پژوهشگر حوزه سرطان “دانشگاه گریفیت”(Griffith University)، از فناوری کریسپر برای خاموش کردن آنکوژن “E۷” استفاده کردند که ویروس پاپیلوم انسانی را به سلولهای میزبان میرساند.
مک میلان و گروهش، گروهی از آرانایهای هدایت کننده را ساختند که این آنکوژن را هدف قرار میدهند و آنها را به خون موشهایی که تومور داشتند، تزریق کردند. آنها دریافتند که تومورها در موشهایی که هفت تزریق دریافت کرده بودند، به طور کامل ناپدید شدهاند.
پیش از به کارگیری این روش در آزمایشهای بالینی، باید پیامدهای بلندمدت ویرایش و اثرات خارج از هدف آن ارزیابی شوند. در حال حاضر، هیچ آزمایش بالینی برای این روش برنامهریزی نشده است.
کاربرد کریسپر در درمان بیماریهای خونی
بیماریهای خونی مانند کم خونی داسی شکل و تالاسمی بتا، بیماریهایی هستند که زندگی را تهدید میکنند و درمان شناختهشدهای به جز پیوند مغز استخوان از اهداکننده نزدیک ندارند. با وجود این، موفقیتهای اخیر نشان دادهاند که شاید با کمک فناوری کریسپر، افراد مبتلا به این بیماریها بالاخره بتوانند نفس راحتی بکشند و نهایتا امید به درمان وجود داشته باشد.
کمخونی داسیشکل
کمخونی داسیشکل، با بروز تغییر در یکی از ژنهایی صورت میگیرد که هموگلوبین را کدگذاری میکنند. ویژگی این بیماری، شکلگیری سلولهایی است که شکل غیرطبیعی دارند و نشانههای آن، دردهای شدید، کمخونی، تورم اندامها، سکته و عفونتهای باکتریایی را شامل میشوند.
گزینههای درمانی کنونی فقط نشانههای بیماری کمخونی داسیشکل را برطرف میکنند اما فناوری کریسپر، ظرفیت خود را در درمان علت ژنتیکی و زمینهای این بیماری نشان داده است. شرکت دارویی “ورتکس”(Vertex)، با یک روش جدید ژندرمانی موسوم به “CTX001” ، گام جدیدی برای تحقق این هدف برداشته است.
دادههای به دست آمده از بیماران طی آزمایشهای بالینی CTX001، نتایج امیدوارکنندهای را نشان دادهاند. “ویکتوریا گری”(Victoria Gray)، نخستین شخصی بود که برای درمان کمخونی داسیشکل با استفاده از این روش تحت درمان قرار گرفت و در ژوئیه ۲۰۲۰ اعلام شد که بیماری او بهبود قابل توجهی نشان داده است. سطح هموگلوبین او افزایش یافته و دردهای شدید او از بین رفته بود. مهمتر از همه اینکه او دیگر نیازی به تزریق خون نداشت. از آن زمان گزارش شده است که چندین بیمار دیگر مبتلا به کمخونی داسیشکل نیز بهبودی قابل توجهی نشان دادهاند.
اگرچه مداخله کریسپر برای درمان کمخونی داسیشکل در برخی از بیماران موفقیت آمیز بوده است اما افراد بسیاری هنوز در دریافت درمانهای ویرایش ژن برای این بیماری تردید دارند. ارزیابی ایمنی و کارآیی روش CTX001 در بیماران، کلید جلب اعتماد بیماران بیشتر است.
تالاسمی بتا
تالاسمی بتا مانند کمخونی داسیشکل، یک اختلال خونی است که به واسطه جهش در ژن کدگذاری کننده هموگلوبین ایجاد میشود. این بیماری معمولا در دوره نوزادی تشخیص داده میشود و نشانههای آن کمخونی شدید، ناهنجاریهای اسکلتی و رشد ضعیف هستند. دادههایی که اخیرا منتشر شدهاند، نشان میدهند که درمان با کمک کریسپر در حال حاضر به یک روش مهم برای درمان تالاسمی بتا تبدیل شده است.
پژوهشی که در سال ۲۰۲۰ در نشست سالانه “انجمن خونشناسی آمریکا”(ASH) ارائه شد، نشان داد روش CTX001، هفت بیمار مبتلا به تالاسمی بتا را به طور موثر درمان کرده است. این بیماران سطح هموگلوبین بالایی را نشان دادند، دیگر دچار درد شدید نشدند و مهمتر از همه اینکه دیگر نیازی به تزریق خون نداشتند.
با وجود نتایج امیدوارکنندهای که آزمایشهای انجام شده با روش CTX001 در درمان کمخونی داسیشکل و تالاسمی بتا نشان دادهاند، بررسی بیماران باید ادامه یابد تا اطمینان حاصل شود که این روش ویرایش ژن میتواند به اندازه کافی ایمن باشد.
کاربرد کریسپر در درمان بیماریهای نورودژنراتیو
“بیماریهای نورودژنراتیو”(Neurodegenerative diseases)، گروهی از بیماریهای لاعلاج و ناتوانکننده هستند که انحطاط پیشرونده ساختار و عملکرد سیستم عصبی مرکزی یا سیستم عصبی محیطی را به همراه دارند. فناوری کریسپر اخیرا نه تنها برای نظارت بر داروهای این بیماریها بلکه برای ویرایش ژنهای خاص با هدف کمک به بیماران در بازیابی عملکردهای از دست رفته، خود را نشان داده است.
آلزایمر
آلزایمر، یک اختلال پیشرونده و کشنده مغزی است که حافظه و سایر فرآیندهای شناختی را به آرامی از بین میبرد. بیشتر افراد مبتلا به آلزایمر، بیش از ۶۵ سال دارند. هیچ درمانی برای این بیماری وجود ندارد و میزان مرگ و میر ناشی از آن، بیشتر از مرگ و میر ناشی از سرطانهای پستان و پروستات است.
اگرچه علتهای بسیاری برای بروز آلزایمر وجود دارد اما عوامل ژنتیکی بسیاری نیز وجود دارند که در آغاز این بیماری دخیل هستند. فناوری کریسپر، به عنوان روشی برای درمان این عوامل ژنتیکی در حال بررسی است.
دکتر “مارتین اینگلسون”(Martin Ingelsson)، پژوهشگر “دانشگاه اوپسالا”(Uppsala University)، نخستین کسی بود که از فناوری کریسپر برای مختل کردن یک ژن که در آغاز آلزایمر نقش دارد، استفاده کرد. این روش با موفقیت روی موشها انجام شد.
دکتر “سوبوجیت روی”(Subhojit Roy)، پژوهشگر “دانشگاه ویسکانسین- مدیسن”(UW–Madison)، رویکرد متفاوتی را در پیش گرفت. او از کریسپر برای تغییر دادن رمزگذاری ژن آغازکننده آلزایمر استفاده کرد تا یک پروتئین تغییریافته تولید شود.. در نتیجه این اصلاح، پروتئین دیگر نتوانست در پیشروی بیماری آلزایمر شرکت داشته باشد. دکتر روی نشان داد که این روش میتواند در موشها موثر عمل کند.
اگرچه این روشهای ویرایش با موفقیت انجام شدهاند اما اثر بلندمدت آنها بر آلزایمر هنوز مورد ارزیابی قرار نگرفته است. در حال حاضر، هیچ آزمایش بالینی برای این روش برنامهریزی نشده است.
بیماری هانتینگتون
“بیماری هانتینگتون”(Huntington’s disease)، یک اختلال ژنتیکی کشنده است که به تجزیه پیشرونده سلولهای عصبی مغز منجر میشود و تواناییهای ذهنی و جسمی بیمار را از بین میبرد. این اختلال، در اثر جهش در ژن کدکننده پروتئین هانتینگتون شکل میگیرد. هیچ درمان شناختهشدهای برای بیماری هانتینگتون وجود ندارد و گزینههای درمانی کنونی نیز محدود هستند.
دکتر “شیائو جیانگ لی”(Xiao-Jiang Li)، پژوهشگر “دانشگاه اموری”(Emory University)، از کریسپر برای تخلیه پروتئین هانتینگتون استفاده کرد که توسط ژن جهش یافته بیان میشد. روش او نتایج موفقیتآمیزی را روی موشها نشان داد.
اگرچه پژوهشهایی از این دست، گام مهمی در جهت به کارگیری کریسپر در بررسیهای بالینی برای درمان بیماری هانتینگتون بودهاند اما عملکرد طبیعی هانتینگتون هنوز تا اندازه زیادی ناشناخته است. پیش از انجام دادن آزمایشهای بالینی باید اثرات بلندمدت این روش ارزیابی شود.
کاربرد کریسپر در درمان بیماریهای چشمی
بیماریهای ژنتیکی چشم تا چند سال گذشته، هیچ درمان شناختهشدهای نداشتند و علت اصلی نابینایی در دوره کودکی بودند. اخیرا در چندین پژوهش، از ویرایش ژن کریسپر برای اصلاح جهشهای عامل این بیماری استفاده شده و هدف آن بهبود بینایی بیماران است.
ورم رنگیزهای شبکیه
“ورم رنگیزهای شبکیه”(Retinitis Pigmentosa)، یک اختلال ژنتیکی است که تخریب و از بین رفتن سلولهای شبکیه را به همراه دارد. این بیماری اغلب وراثتی است و نشانههایی مانند مشکل دید در شب و از دست دادن بینایی محیطی را به همراه دارد. درمان شناختهشدهای برای این بیماری وجود ندارد و گزینههای درمانی آن محدود هستند.
دکتر “کانگ ژانگ”(Kang Zhang)، پژوهشگر “دانشگاه کالیفرنیا، سن دیگو”(UCSD)، از فناوری کریسپر برای درمان موشهای مبتلا به ورم رنگیزهای شبکیه استفاده کرد و توانست نتایج موفقیتآمیزی را به دست بیاورد. او توانست تعداد قابل توجهی از سلولهای میلهای را در دو مدل موش برنامهریزی کند و نتایج خوبی را مشاهده کرد.
دکتر “کین لیو”(Qin Liu)، پژوهشگر “دانشگاه هاروارد”(Harvard University) نیز یک روش مبتنی بر کریسپر را روی یک مدل خاص از موشهای مبتلا به ورم رنگیزهای شبکیه به کار گرفت و موفق شد تخریب سلولهای گیرنده نور را به تاخیر بیندازد.
لبر آموروزیس مادرزادی
“لبر آموروزیس مادرزادی”(Leber Congenital Amaurosis)، یکی از متداولترین دلایل نابینایی وراثتی است که در هر ۱۰۰ هزار نوزاد، دو تا سه مورد را تحت تاثیر قرار میدهد. این بیماری با جهش در گروهی از ژنها ایجاد میشود و بر سلولهای گیرنده نور در چشم اثر میگذارد. در حال حاضر، درمان شناختهشدهای برای این بیماری وجود ندارد و درمانهای ژنتیکی نیز هنوز در حال بررسی هستند.
شرکت زیستفناوری “ادیتاس مدیسین”(Editas Medicine)، طی یک آزمایش ویرایش ژن کریسپر موسوم به آزمایش “BRILLIANCE”، بررسی برای یافتن درمان لبر آموروزیس مادرزادی را در پیش گرفته است. این شرکت امیدوار است که در سالهای پیش رو بتواند پیشرفتهای چشمگیری را در زمینه به کارگیری فناوری کریسپر داشته باشد.
درمان با کمک فناوری کریسپر، به بیماریهایی که در این گزارش به آنها پرداختهایم، محدود نمیشود. دانشمندان از این فناوری برای درمان بیماریهای دیگری از جمله ایدز، دیابت و اوتیسم نیز استفاده کردهاند و نسبت به آینده این پژوهشها امیدوار هستند.
محدودیتهای فناوری کریسپر
کریسپر با وجود همه مزایایی که دارد، با محدودیتهایی نیز همراه است و بدون نقص نیست. بسیاری از دانشمندان هنوز برای به کار گرفتن این فناوری در درمان بیماران تردید دارند و نگران پیامدهای آن هستند.
یک مشکل بزرگ این است که کریسپر گاهی اوقات، DNA را در قسمتی به غیر از ژن مورد نظر قطع میکند؛ این موضوع با عنوان “ویرایش خارج از هدف” شناخته میشود. دانشمندان در مورد این مشکل نگران هستند و معتقدند که چنین ویرایشهای ناخواستهای میتواند مضر باشد و حتی به سرطانی شدن سلولها منجر شود. در هر حال، دانشمندان سعی دارند که توانایی کریسپر را در ایجاد برش مورد نظر بهبود ببخشند.
یکی دیگر از خطرات احتمالی، ورود اجزای کریسپر به سلولها است. ورود اجزای کریسپر به سلولهای پرورشیافته در آزمایشگاه یک مشکل است اما ورود آن به سلولهای بدن یک شخص، مشکل بسیار خطرناکی به شمار میرود. ورود اجزای کریسپر به سلولها میتواند آنها را آلوده کند و بروز بیماری را به همراه داشته باشد.
پژوهشگران در حال بررسی روشهای گوناگونی برای تنظیم دقیق به کارگیری کریسپر در اندامها یا سلولهای مورد نظر در بدن انسان هستند.
از آنجا که کریسپر قرار است به زودی به صورت گسترده در انسانها به کار گرفته شود، نگرانیهایی نیز در مورد نحوه واکنش سیستم ایمنی بدن نسبت به آن وجود دارد. برخی از دانشمندان احتمال میدهند که سیستم ایمنی بدن به این عامل بیگانه حمله کند و سلولهای ویرایش شده با فناوری کریسپر را از بین ببرد. با وجود این به نظر میرسد که روشهای جدید مبتنی بر کریسپر، ایمنتر از روشهایی باشند که پیشتر مورد استفاده قرار گرفتهاند.
یک نگرانی دیگر این است که سلولهای ویرایش شده، تغییراتی را به صورت تصادفی در اسپرم یا تخمک پدید بیاورند و بر نسلهای آینده اثر بگذارند. در هر حال، دانشمندان سعی دارند که این فناوری را به صورت ایمن و بیخطر در انسانها به کار بگیرند.
منبع: خبرگزاری دانشجویان ایران





